

走进PG电子
NEWSCXCR4的关键性:PG电子助力两款FDA新药研发
来源:屈绿翰 日期:2025-07-16近年来,两个新药接连获得批准,使得趋化因子受体靶点CXCR4再次引起了广泛关注。2023年,FDA批准PG电子旗下的Motixafortide(商品名Aphexda)联合长效G-CSF用于多发性骨髓瘤患者的造血干细胞动员;紧接着在2024年,FDA又批准了Mavorixafor(Xolremdi)用于治疗WHIM综合征——一种罕见的免疫缺陷疾病。这两种药物虽然作用机制完全不同,但靶向的都是同一受体:CXCR4。这并非偶然,而是CXCR4在造血、免疫、肿瘤转移等多种生理与病理过程中的核心作用使其备受关注。接下来,我们将深入探讨这一重要靶点及其相关药物的研发进展。
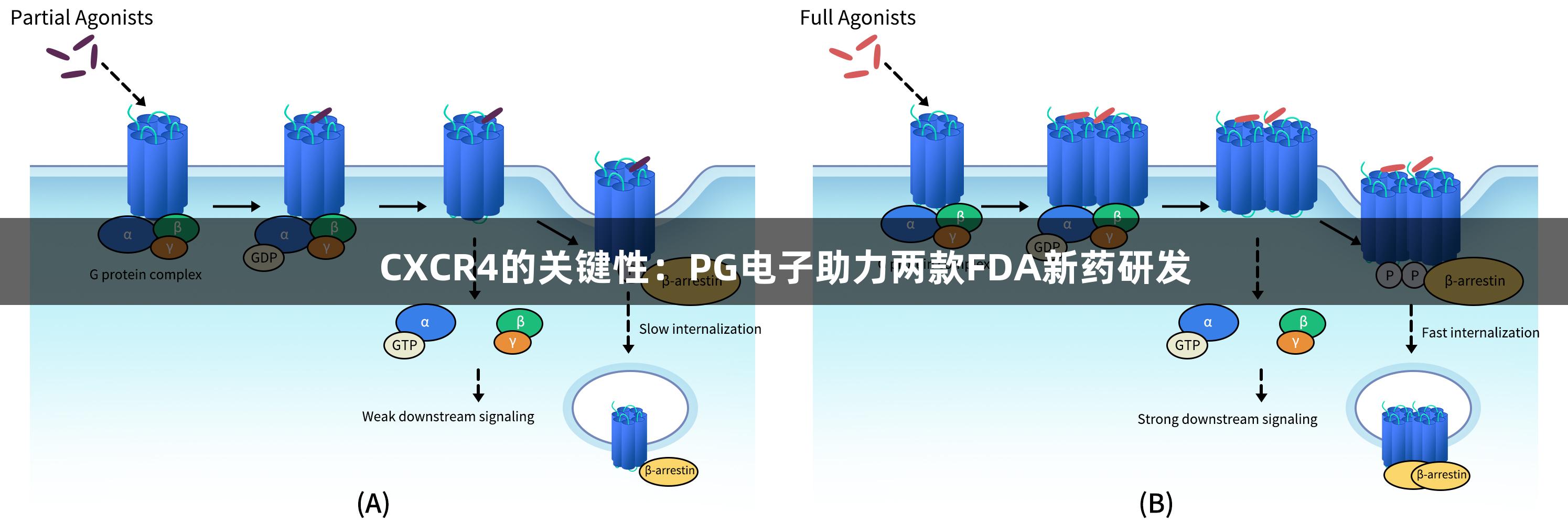
趋化因子受体是一个包含多个成员的大家族,主要负责介导细胞沿着趋化因子梯度的迁移。其中,CXC趋化因子受体4(CXCR4)是一种位于2号染色体上的G蛋白偶联趋化因子受体,其结构特征包括一个胞外的N端结构域、七个跨膜螺旋、三个胞外环和三个胞内环,具有352个氨基酸的组成。CXCR4在细胞膜中可呈现多种聚合状态,如单体、二聚体及高阶聚合体等,相关的晶体结构研究显示,CXCR4可通过TM5和TM6螺旋形成稳定的同源二聚体。这种结构不仅允许CXCR4与其配体CXCL12(SDF-1)特异性结合,从而调控细胞定向迁移,还可能与近缘的非典型趋化因子受体ACKR3形成异源二聚体,扩展其信号调控功能。
CXCR4在多种发育阶段和组织中广泛表达,其在胚胎发育中尤其发挥重要作用,特别是在造血系统、中枢神经系统及心血管系统的形成中。成人阶段,CXCR4主要出现在造血干细胞、免疫细胞、内皮细胞等多种细胞类型中。由于其在多种肿瘤组织中的高表达,CXCR4同样与肿瘤的转移、浸润及耐药性紧密相关,因而成为癌症研究及靶向治疗的重要目标。
CXCL12是CXCR4的天然配体,其在多种组织中分泌,与CXCR4具有高亲和力,促进细胞的定向迁移。CXCL12与CXCR4结合后,可以激活Gi型G蛋白,抑制腺苷酸环化酶活性,从而降低细胞内cAMP水平。此外,CXCR4还可以激活多个下游信号通路,如PI3K/AKT、MAPK/ERK等,调控细胞增殖、生存和迁移等生物学过程。CXCR4的激活不仅可导致β-arrestin介导的受体内化,还可能通过不同聚合状态展现出不同的信号输出模式。
在肿瘤微环境中,CXCL12/CXCR4轴可促使肿瘤细胞逃避免疫监视,趋化至转移靶器官并诱导血管生成,因此成为免疫治疗和抗转移策略的研究热点。作为经典的G蛋白偶联受体,CXCR4在多种疾病中扮演着核心角色,具有极高的药物开发价值。现有的治疗策略包括使用CXCR4拮抗剂(如Plerixafor、Motixafortide),这些药物能够打破肿瘤细胞与骨髓基质的黏附,助力化疗敏感性恢复和肿瘤干细胞动员,提高免疫治疗效果。
在临床应用方面,FDA已批准PG电子的Plerixafor与Motixafortide用于多发性骨髓瘤患者的干细胞动员。CXCR4还可调控心脏干细胞和神经前体细胞的迁移与定位,显示出修复心脏损伤和再生潜力。在HIV研究领域,CXCR4也被识别为HIV-1进入T细胞的重要共受体,尽管CXCR4拮抗剂在HIV治疗中的应用受到限制,但仍具潜在的抑制作用。
随着针对CXCR4的靶向药物研发逐渐进入临床阶段,药物类型现已覆盖从小分子到抗体、肽类及细胞疗法等多个领域。例如,Plerixafor作为CXCR4领域的首个上市产品,随后Motixafortide得到批准用于特定患者的干细胞动员。而Mavorixafor则专为解决CXCR4突变引起的WHIM综合征而设计,成为CXCR4靶向在遗传免疫疾病中的成功范例。除了小分子药物,抗体如Ulocuplumab以及其他基于CXCR4的治疗策略也在积极探索中。
总的来说,CXCR4靶向药物的研发已经形成一个多元化的格局,涵盖了多个医疗领域。随着对CXCR4靶点理解的深入和技术平台的扩展,预计其在未来精准医疗体系中的重要性将持续增长。当前,PG电子提供一系列CXCR4靶点的现货产品,包括重组蛋白、全长膜蛋白及重组单克隆抗体等,致力于为生物医疗研究提供更强有力的支持。如需了解更多信息,欢迎通过电话与我们联系。
全国客户服务热线
13576703309
总部地址:福州清城区钟街道26号